|

Il primo tentativo per lo sviluppo di una
sorgente elettrochimica di corrente fu compiuto da Galvani nel 1789 (fanoso esperimento
con la rana). Negli anni (1792) riuscì a realizzare la pila di corrente e a
formulare la prima teoria sulla produzione elettrochimica della corrente.Nel
1803 Ritter notò che il passaggio della corrente elettrica attraverso due
elettrodi immersi in una soluzione di elettrolita (Cu/NaCl/Cu) generava
polarizza- zione. E' questa osservazione, la pila di Ritter, il punto di per
la realizzazione di dispositivi atti ad immagazzinare corrente lettrica.
Passarono 50 anni e una nuova, determinante osservazione diede un decisivo
impulso alla costruzione delle batterie ( Sindstenden nel 1854 e Planté nel
1859). Nel 1860, infatti, venne costruito il primo prototipo di batteria
costitutito da lamine di piombo interposte a sottili strati di comune
tessuto, il tutto immerso in una soluzione al 10% di acido solforico (H2SO4).
Le prime osservazioni su questo modello evidenziarono una correlazione tra
quantità di energia immagazzinata e quantità di biossido di piombo formato.
Inoltre, alcuni anni dopo (1868), fu notato che la capacità della pila
aumentava attraverso una lunga e ripetuta carica. Finalmente, nel 1876,
l'invenzione della dinamo ad opera di Siemens, permise l'utilizzo dei primi
accumulatori al piombo nelle centrali elettriche quali dispositivi di immagazzinamento
della corrente nelle ore notturne. Il contributo di altri pionieri (Planté,
Faure nel 1881 e Tudor nel 1883) permise di perfezionare gli accumulatori.
All'ultimo scienziato si deve il merito di aver ideato le griglie.
|
Ovviamente, nel corso degli
anni i componenti delle batterie di automobile e di altri veicoli hanno
subito una notevole evoluzione. Dalle prime batterie formate da contenitori
di gomma racchiusi in gabbia di legno, si è passati gradualmente a
contenitori monoblocco di gomma dura (polvere di antracite con il 5-10% di
gomma dura più olio plasticizzante e piccole quantità di solfuri e calce) con
pareti esterne spesse 0,5-0,6 cm ed interne di 0,3 cm agli attuali
contenitori in polipropilene (1960).
Quest'ultimo contenitore offre alcuni vantaggi rispetto al precedente:
maggiore robustezza, minore peso, ciclo di lavorazione industriale più
breve,ecc.
A parte il contenitore, la batterie si compone di vari elementi. Ogni
elemento è costituito da un certo numero di elettrodi positivi e negativi.
Gli elettrodi o piastre sono formati da un impasto di sostanza attiva
sostenuto da uno scheletro denominato griglia. La griglia è formata da una
lega metallica al piombo con altro metallo, generalmente antimonio. La
funzione di questo elemento è quella di fornire maggiore resistenza e
capacità al piombo nel sostenere la sostanza attiva. Una bassa percentuale di
questo metallo (2%) consente alla batteria un maggiore mantenimento della
carica e una riduzione del processo di autoscarica. E' possibile ancora
riscontrare piccole percentuali di arsenico.
L'impasto che si deposita sulle griglie è costituito dal 70-80% di ossido di
piombo (PbO) e dal 20-30% di piombo metallico ed è uguale per entrambe le
piastre, positive e negative. In queste ultime sono presenti gli expanders
che hanno la funzione di aumentare, specie alle basse temperature, di un
fattore di alcune centinaia per cento la capacità della batteria.
Gli expanders sono formati da bario solfato, carbone attivo e derivati della
lignina in ragione dello 0,2-0,5 % in peso.
Il rapporto tra impasto e le griglie dovrebbe essere compreso tra 1:5 e 2:1.
Le piastre impastate, elettrodi positivi e negativi, devono essere separati
ad evitare di cortocircuitare. A tal fine si frappongono dei separatori
formati da sostanze non conduttrici e geometricamente particolari per
assicurare la più grande circolazione di elettrolita : AI derivati della
lignina, impiegati un tempo, oggi si preferisce sostituire le resine
fenoliche, lana di vetro, gomma naturale, ecc.
Il separatore ideale dovrebbe impedire la penetrazione della sostanza attiva
tra una piastra e l'altra e permettere una buona permeabilità elettrica e
quindi una bassa resistenza chimica e alta conduttività ionica.
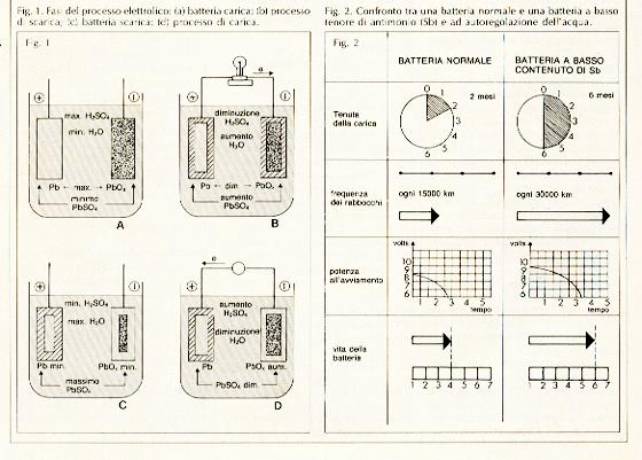
Funzionamento della
batteria.
Gli ossidi di piombo (PbOx) e lo stesso Piombo diventano attivi se immersi in
una soluzione di elettrolita. Nel caso delle batterie di automobile questo è
costituito da acido solforico diluito in proporzione del 35% in peso e del
24% in volume. L’acido solforico provoca la solfatazione delle piastre e
conseguente produzione di energia elettrica (e). In effetti la reazione
chimica che sta alla base del processo elettrolitico ( reazione di carica e
scarica) è l’equazione di Gladstone e Tribe (1881) :
PbO2 + Pb + 2 H2SO4 D 2 PbSO4 + 2
H2O
Questa reazione è la somma
di due processi, quello che si realizza all’elettrodo negativo (1) e quello
che si realizza all’elettrodo positivo (2):
Pb + SO4D PbSO4 +
2e
(1)
PbO2 + 4 H
+ SO4 +
2e D PbSO4 + 2 H2O
|